(本实验只能校内使用)
实验的必要性和实用性
本虚拟实验项目既可以作为细胞生物学综合实验的必要组成部分,又可以独立作为应激条件下线粒体结构、功能检测的系统实验。
1.综合实验的必要组成部分
我们目前开设的细胞生物学实验采用综合实验的系统性教学,以期学生在掌握实验技术的同时,提升科研设计能力,培养科研思维。
具体的设计方案包括在学生掌握细胞培养的基础上,检测不同应激条件对细胞增殖的影响和可能机制。然而受限于实验条件和课时,综合实验有部分内容无法在现实实验教学中体现,学生在科研设计过程中存在一定的思维跳跃感。
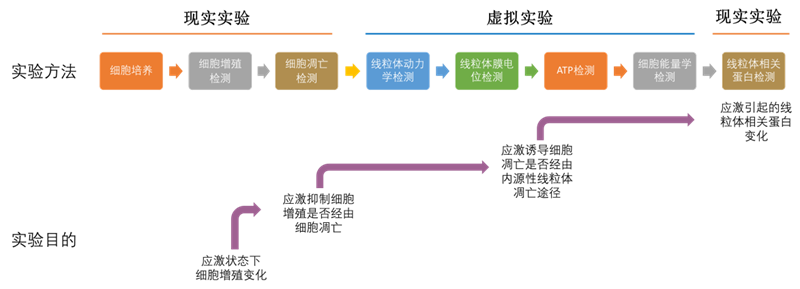
较系统和完整的综合实验教学方案应该首先通过CCK-8法检测不同应激状态下细胞增殖的变化,随后学生根据实验结果结合文献资料分析,探讨应激诱导的细胞增殖变化是否与细胞凋亡有关。
细胞凋亡主要包括内源性线粒体凋亡途径和外源性死亡受体凋亡途径,一般的科研设计思路是通过实验明确应激诱导细胞凋亡后,进一步探讨应激诱导的凋亡经由哪种途径,并在此基础上分析可能的相关蛋白的变化而此部分实验方法涉及激光共聚焦显微镜、Seahorse细胞能量代谢分析仪和荧光酶标仪等高成本、高消耗的实验仪器,无法在本科教学中开展,目前在实验教学过程中只能通过文献介绍,略过该部分实验检测。然而学生对文献结果替代该部分实验结果并不十分认可,也导致学生在实验设计过程不能更好地有的放矢。
因而本虚拟仿真实验项目拟通过虚拟现实技术完成现实实验缺如的部分,设计了四个与线粒体结构、功能相关的“线粒体能力学”虚拟实验,旨在探讨应激诱导的细胞凋亡是否经由线粒体凋亡途径。主要包括了应激条件下线粒体动力学(融合分裂)、膜电位、ATP以及能量代谢的变化,是细胞生物学综合实验的必要组成部分。而虚拟实验与现实实验结合使细胞生物学综合实验的设计更加完整,更有助于学生科研能力的培养。
2.独立的系统性实验设计
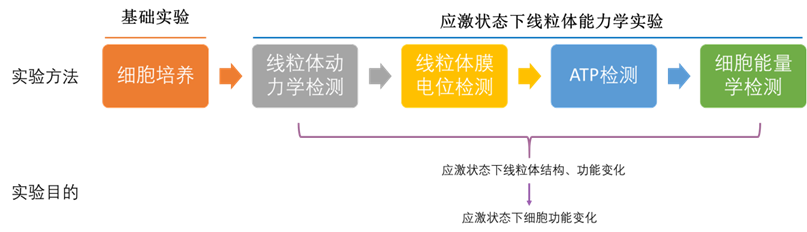
线粒体是真核细胞内能量产生的关键细胞器,线粒体功能紊乱与多种疾病的发生发展有关,应激条件下线粒体超微结构变化和功能紊乱将导致细胞能量异常。本虚拟仿真实验项目包括应激条件下线粒体动力学(融合与分裂)、线粒体膜电位、ATP水平和细胞能量代谢变化四个方面,很好的体现了应激诱导的线粒体超微结构和功能变化。本部分内容相辅相成,系统的展现了应激状态下线粒体结构和功能的异常。而本部分实验中使用的激光共聚焦显微镜、Seahorse细胞能量代谢分析仪和荧光酶标仪等高成本、高消耗的实验仪器在本科教学中无法开展。
新冠疫情导致部分线下教学的暂停,对实验课程的线上教学也提出了更大的挑战,而本虚拟仿真实验项目结合细胞培养的基础虚拟仿真实验(细胞传代、细胞冻存和细胞复苏)能够很好的完成细胞生物学教学的目标。由于本虚拟实验项目设计的独立性和系统性,除应用于突发公共卫生事件的线上教学,也完全适用于其他高校、医院、技术学院和个人等的细胞生物学虚拟实验教学。
教学设计的合理性
1.综合实验的设计原则
在细胞生物学实验课程的教学过程中,学生首先需掌握基础的细胞培养相关实验技术,在此基础上给予细胞应激处理,检测应激条件下细胞增殖的变化。学生根据结果分析应激条件下细胞增殖的变化,结合查阅的文献,设计下一步的实验计划,探讨引起细胞增殖改变的可能原因,包括细胞凋亡。应激诱导的细胞凋亡主要包括内源性线粒体凋亡途径和外源性死亡受体凋亡途径,为了探讨应激诱导的细胞凋亡经由那种途径,可以检测与线粒体凋亡途径相关的线粒体超微结构、线粒体膜电位、ATP水平、细胞能量代谢等变化。学生将通过虚拟实验完成应激条件下,上述线粒体结构和功能变化的检测。依据虚拟实验检测结果和文献分析结果,筛选应激条件下与线粒体凋亡途径相关的蛋白分子或信号转导通路,并通过现实实验予以验证。
整个教学过程虚实结合,科研设计完整,有效的培养了学生的科研思维。
2.独立系统性实验的设计原则
学生首先完成基础的细胞培养虚拟仿真实验(细胞传代、细胞冻存和细胞复苏),掌握细胞培养相关知识和无菌操作的原则。在此基础上,学生通过查阅文献设计应激状态下,细胞线粒体结构和功能可能的变化情况,并基于此设计出可行的实验。学生通过完成线粒体动力学(融合和分裂)检测、线粒体膜电位检测、ATP检测以及细胞能量学检测的虚拟仿真实验,了解应激条件下线粒体结构和功能的变化。整个教学过程科研设计完整,实验方法和结果相辅相成。
实验系统的先进性
本虚拟实验采用3D虚拟现实场景技术,让所有的实验物品看起来更加真实,通过unity平台制作技术进行模型、动画场景整合,让整个虚拟实验操作给人更加身临其境的体验。结合H5 WebGL前端显示与先进的Addressable可寻址资产系统,大大降低了系统开销及应用终端的限制,结合主流浏览器Chrome、Firefox等,让虚拟实验平台在保证教学需求及流畅度的同时,应用门槛大大降低,提高视觉显示效果。
(1)实验原理(限1000字以内)
本虚拟仿真实验包括基础的细胞培养相关的实验技术(细胞传代、细胞冻存和细胞复苏)(细胞线粒体能力学实验1期,已完成已使用),以及在此基础上给予细胞应激处理,检测应激条件下线粒体动力学(融合和分裂)、线粒体膜电位、ATP以及细胞能量学指标(细胞线粒体能力学实验2期)。
细胞传代实验原理:体外生长的培养细胞受营养条件、生长空间等因素的限制,当细胞增殖达到一定密度后,需要分离出一部分细胞和更新营养液进行扩大培养,此过程称传代。
细胞冻存实验原理:为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞放在低温环境,减少细胞代谢。通常使用-196℃的液氮进行细胞冻存,冻存过程中需要加入冻存液,缓慢冷冻。
细胞复苏实验原理:细胞复苏是指将冻存的细胞重新活化,使之生长,进入细胞周期。应采用快速融化的手段,保证细胞外冰晶在很短的时间内融化,并避免由于缓慢融化使水分渗入细胞内形成胞内再结晶对细胞造成损害。
细胞增殖检测(CCK-8法)实验原理:细胞增殖检测用于分析细胞分裂中细胞数量的变化,进而反应细胞的生长状态及活性。WST-8是一种化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲臜,具有高度水溶性。生成橙黄色甲臜的数量和活细胞的数量成正比。
线粒体动力学(融合和分裂)实验原理:正常情况下,线粒体在细胞内相互连接成网状结构,频繁的发生着融合与分裂,两者之间的动态平衡维持着线粒体的形态和功能。在细胞调亡的早期,线粒体融合和分裂失衡,线粒体管网状结构碎裂,导致线粒体片段化。
线粒体膜电位实验原理(JC-1法):线粒体的跨膜电位是线粒体功能状态的一个重要指标,可以驱动一些亲脂性阳离子荧光染料如JC-1等进入到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。在线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合体,可以产生红色荧光;在线粒体膜电位较低时,不能聚集在线粒体基质中,此时为单体,可以产生绿色荧光。可以通过荧光颜色的转变来检测线粒体膜电位的变化。常用红绿荧光的相对比例衡量线粒体去极化的程度。
ATP检测实验原理:ATP是细胞内能量的主要供应形式,正常情况下主要由线粒体产生。细胞内ATP的水平是细胞能量代谢的一个重要指标,通常细胞处于应激条件下,ATP水平会明显下降。用虫荧光素酶—荧光素系统测定细胞中ATP含量的原理是虫荧光素酶、还原型荧光素和在ATP在Mg2+及氧气的参与下反应,其生成的光量子h与一定量的ATP呈正相关。
细胞能量代谢检测(Seahorse细胞能量代谢分析)实验原理:线粒体氧化磷酸化和糖酵解是细胞内重要的能量产生途径,分别涉及细胞耗氧量和质子释放率。Seahorse细胞能量代谢分析技术使用无标记传感器检测这些分析物中的细胞外变化,以测定细胞呼吸率和糖酵解。
知识点:共16个
细胞线粒体能力学实验2期
1.线粒体概述
2.线粒体形态
3.线粒体融合与分裂
4.线粒体内源性凋亡途径
5.线粒体膜电位
6.ATP产生
7.氧化磷酸化
8.糖酵解
细胞线粒体能力学实验1期
1.细胞培养
2.细胞培养的无菌环境
3.细胞培养的无菌操作
4.细胞传代
5.细胞冻存
6.细胞复苏
7.细胞增殖
8.细胞凋亡
(2)核心要素仿真设计(对系统或对象的仿真模型体现的客观结构、功能及其运动规律的实验场景进行如实描述,限500字以内)
整个虚拟实验采用3D技术完全再现现实实验室所有的实验场景、仪器设备和试剂用品等。由于整个虚拟仿真实验交互步骤过多,仅以超净台、显微镜、手持计数器和离心机的使用为例进行描述。
实验涉及无菌原则的所有操作,学生需在虚拟超净台中完成。通过鼠标拖拽,虚拟超净台会立体旋转,给学生以真实超净台相同的体验感。
学生用虚拟显微镜观察细胞,需选取合适的显微镜,如活细胞的观察需选用倒置显微镜,然后才能完成细胞的观察,观察结果会通过图片形式呈现,给学生以身临其境的感觉。
学生如果需要用虚拟手持计数器进行细胞计数时,需通过鼠标拖拽手持技术器至超净台,模拟现实实验中,学生将手持计数器取至超净台。手持计数器计数细胞的结果会呈现在计数器屏幕上,完全模拟现实实验中的计数结果。
学生使用虚拟离心机进行细胞悬液离心操作,首先需要调整好离心机的参数,包括转数和时间,模拟现实实验室中的离心过程。只有在参数设置正确的情况下,才能进行下一步的离心操作。
此外,虚拟实验在细节处理上也有着很好的设计,如移液器枪尖和废液的丢弃,液氮罐使用需要防护手套等,都完全模拟了现实实验室的操作过程。
1.综合实验的教学过程(虚实结合)
2.独立系统性实验的教学过程(虚拟教学)
(1)学生交互性操作步骤,共307步
其中细胞传代22步;细胞冻存33步;细胞复苏20步;线粒体动力学检测(融合与分裂)56步;线粒体膜电位检测60步;线粒体ATP检测56步;细胞能量代谢检测60步。因为交互性操作步骤较多,故选取部分交互步骤进行介绍。
步骤序号 |
步骤目标要求 |
步骤合理用时 |
目标达成度赋分模型 |
步骤满分 |
成绩类型 |
1 |
取出水浴锅中温浴的染色工作液,放置于超净台上 |
1min |
完成率 |
2 |
£操作成绩 √实验报告 £预习成绩 √教师评价报告 |
2 |
线粒体动力学检测(融合与分裂)实验中对照组的设置 |
2min |
完成率 |
4 |
|
3 |
线粒体动力学检测(融合与分裂)实验中处理组的设置 |
2min |
完成率 |
4 |
|
4 |
激光共聚焦显微镜检测线粒体融合分裂 |
4min |
完成率 |
5 |
|
5 |
手持计数器计数细胞密度 |
1min30s |
完成率 |
2 |
|
6 |
激光共聚焦显微镜检测线粒体膜电位 |
6min |
完成率 |
8 |
|
7 |
接种细胞于96孔细胞培养板内 |
1min |
完成率 |
1 |
|
8 |
荧光酶标仪检测ATP水平 |
5min |
完成率 |
5 |
|
9 |
使用离心机进行离心 |
2min |
完成率 |
2 |
|
10 |
匀浆器对细胞悬液进行匀浆操作 |
2min |
完成率 |
2 |
(2)交互性步骤详细说明
因为交互性操作步骤较多,故对表格选取的部分交互步骤进行详细介绍。
1.取出水浴锅中温浴的染色工作液,放置于超净台上
此过程涉及多个交互操作步骤,学生需要通过鼠标点击实验设备,在实验设备栏选取水浴锅,此时画面会从超净台转移至水浴锅,而在进入下一步前,学生需思考“请思考Mito-Tracker Green的工作原理是什么?”思考后记录至实验报告,并点击确定进入下一步,取出温浴的Mito-Tracker Green染色工作液。点击实验设备,选择超净台,此时画面会转回至超净台上,将温浴后的染色液放置于超净台内的EP管架上。
2.线粒体动力学检测(融合与分裂)实验中对照组的设置
点击实验试剂栏,拖拽培养基C(含10%胎牛血清的DMEM)至超净台,使用蓝色(量程1000μl)的移液器吸取培养基溶液。此时屏幕上会出现计量设定的对话框,学生需选择正确的计量,此步骤为1ml即1000μl才能进入下一步。根据提示将1ml的培养基溶液加入培养皿。进而点击实验设备,选择培养箱,画面会从超净台转至培养箱。将培养皿放入培养箱后,对话框提示“将培养皿中的细胞培养2小时!”。
3.线粒体动力学检测(融合与分裂)实验中处理组的设置
点击实验试剂栏,拖拽过氧化氢-培养基(终浓度为100μl的过氧化氢)至超净台,使用蓝色(量程100~1000μl)的移液器吸取培养基溶液。此时屏幕上会出现计量设定的对话框,学生需选择正确的计量,此步骤为1ml即1000μl才能进入下一步。根据提示将1ml的培养基溶液加入培养皿。进而点击实验设备,选择培养箱,画面会从超净台转至培养箱。将培养皿放入培养箱后,对话框提示“将培养皿中的细胞培养2小时!”。
4.激光共聚焦显微镜检测线粒体融合分裂
点击实验设备栏,鼠标点击选择激光共聚焦显微镜。将培养皿放置于显微镜的载物台上,模拟激光共聚焦显微镜的动态拍摄,每隔30s拍摄一次,拍摄10分钟(会跟学生强调该时间和方法,但实际不需要真正等待10分钟)。结果显示对照组和处理组的结果,学术需要对结果进行分析和讨论。
5.手持计数器计数细胞密度
点击器材与工具栏,拖拽手持计数器至超净台,模拟现实实验中取出手持计数器至超净台的环节。拖拽手持计数器至离心管2(细胞悬液)处,从中吸取细胞悬液进行细胞计数。技术结果会在手持计数器屏幕上显示,为了更加清晰的显示结果,计数器屏幕会放大。之后学生需根据计数结果计算后续细胞接种密度。
6.激光共聚焦显微镜检测线粒体膜电位
鼠标点击实验设备栏,点击选择激光共聚焦显微镜。此时屏幕会出现“请思考可能会出现怎样的结果?为什么?”,学生需要对预期结果进行思考,并记录至实验报告。思考完毕后,点击确定将检测的6孔板放置于激光共聚焦显微镜上,根据图片显示结果进行分析、讨论。
7.接种细胞于96孔细胞培养板内
根据细胞计数器计数的细胞密度,对细胞悬液进行稀释,使细胞悬液的终浓度为5×104/ml。拖拽红色(量程为10~200μl)的移液器至离心管3(稀释好的细胞悬液),吸取200μl细胞悬液,接种至96孔培养板其中的一孔内。并使用同样的方式为96孔培养板的其他孔也加入细胞悬液,200μl每孔,共分两组8孔。
8.荧光酶标仪检测ATP水平
鼠标点击实验设备栏,点击选择荧光酶标仪,将96孔培养板放置荧光酶标仪处。待仪器自检后,拖拽96孔板放入孔板架上,并进行检测。检测数据会以图片形式显示,并要求学生根据检测结果(A1-A4为正常组,A6-A9为处理组),进行统计分析,并对结果进行讨论、完成实验报告。
9.使用离心机进行离心
点击实验设备栏,选择离心机,将离心管1(单细胞悬液)放置于离心机旁,画面会从超净台移动到离心机前。通过鼠标点击开关按钮,通过上下键调整离心机的温度至20℃,转速为1000rpm,时间为5min。参数调整好后,打开离心机,拖拽离心管1进入离心机。关闭离心机,开始离心。
10.匀浆器对细胞悬液进行匀浆操作
鼠标点击器材与工具栏,拖拽细胞匀浆器至超净台,模拟现实实验中将细胞匀浆器取至超净台的步骤。拖拽匀浆器至Ep管1(单细胞悬液)处,对细胞进行匀浆操作,总计10次,每次5秒,间隔10秒。
线粒体动力学(融合与分裂)检测、线粒体膜电位检测、ATP检测和细胞能量代谢检测均设计有应激刺激的操作步骤,学生选取对照组和处理组会有不同的实验操作,也会得到完全不同的实验结果,对比对照组和处理组的结果会得出应激条件下相应指标的变化,进而明确应激条件下线粒体结构和功能的变化情况。
虚拟实验教学平台采用B/S架构,包括:实验前相关知识的辅助学习、实验过程的答疑与指导、实验教学效果评估等。采用主流的3D虚拟仿真技术,结合H5 WebGL前端显示与先进的Addressable可寻址资产系统,大大降低了系统开销及应用终端的限制,结合主流浏览器Chrome、Firefox等,让虚拟实验平台在保证教学需求及流畅度的同时,应用门槛大大降低,提高视觉显示效果。
开发技术 |
£VR £AR £MR R √3D仿真 √二维动画 √HTML5√Addressable £其他 |
开发工具 |
√ Unity3D √3D Studio Max £Maya √ ZBrush £SketchUp √Adobe Flash £Unreal Development Kit √ Animate CC £Blender √ Visual Studio £其他 |
服务器 CPU 4核以上、内存4GB以上、磁盘2GB以上、显存4GB以上、GPU型号:GTX950以上 操作系统 Windows Server 具体版本: 数据库 Mysql £其他 备注说明(需要其他硬件设备或服务器数量多于1台时请说明) 是否支持云渲染:○是√否 |